インスリン受容体 (インスリンじゅようたい、英: Insulin receptor、IR) は、インスリンとインスリン様成長因子によって活性化される膜貫通タンパク質受容体で、受容体型チロシンキナーゼのクラスに属する。代謝的観点では、インスリン受容体はヒトなどにおいて血糖値の恒常性の調節という重要な役割を果たし、機能の悪化によって糖尿病やがんを含む一連の臨床症状がもたらされる。インスリンのシグナルは、多くの細胞において血中にあるグルコースへのアクセスを制御する。インスリンの血中濃度が低下した時、特にインスリン感受性が高い場合には、体細胞は膜を越えて輸送する必要のない脂質にだけアクセスするようになる。このように、インスリンは脂肪の代謝においても主要な調節因子である。生化学的観点では、インスリン受容体は単一のINSR遺伝子によってコードされ、選択的スプライシングによってIR-AまたはIR-Bのアイソフォームが生じる。これらは翻訳後のタンパク質分解によってαとβのサブユニットへ切断される。これらのアイソフォームはホモ二量体またはヘテロ二量体化し、ジスルフィド結合で連結された約320 kDaの膜貫通インスリン受容体が形成される。
構造
INSR遺伝子のスプライスバリアントの翻訳によって、2種類の単量体のアイソフォーム(IR-A、B)が形成される。IR-Aは11番目のエクソンが除去されたものであり、IR-Bには11番目のエクソンが含まれている。11番目のエクソンが含まれることにより、IR-Bにはフーリンによる切断部位の上流に12個のアミノ酸が挿入される。
N末端側のα鎖とC末端側のβ鎖へ切断されると、12個のアミノ酸はα鎖のC末端 (αCT) に位置することとなる。この部位は受容体とリガンドの相互作用に影響を与えていると予測されている。
各単量体は、構造上8つの異なるドメインに組織化される。ロイシンリッチ反復ドメイン(leucine-rich repeat domain、L1、1–157番残基)、システインリッチ領域(cysteine-rich region、CR、158–310番残基)、2つ目のロイシンリッチ反復ドメイン(L2、311–470番残基)、3つのフィブロネクチンIII型ドメイン FnIII-1(471–595番残基)、FnIII-2(596–808番残基)、FnIII-3(809–906番残基)、さらに、FnIII-2ドメイン内にはα/βフーリン切断部位を含む挿入ドメイン(insert domain、ID、638–756番残基)があり、切断によってIDα、IDβドメインとなる。β鎖にはFnIII-3ドメインの下流に膜貫通ヘリックス (transmembrane helix、TH)、細胞内の膜近接領域 (juxtamembrane region、JM) があり、その下流には細胞内のチロシンキナーゼ触媒ドメイン (tyrosine kinase catalytic domain、TK) が存在し、細胞内のシグナル伝達を担っている。
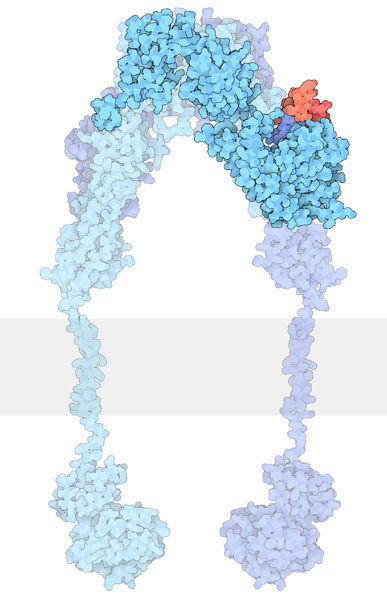
各単量体はα鎖とβ鎖へ切断されるが、受容体のホモまたはヘテロ二量体構造は、各単量体内のα鎖とβ鎖間に形成される1つのジスルフィド結合と、各単量体のα鎖間に形成される2つのジスルフィド結合によって共有結合的に維持される。細胞外領域全体には4つのリガンド結合部位があり、その立体構造は逆V字型をしている。各単量体は逆V字に平行な軸に関して擬似2回対称であり、各単量体のL2ドメインとFnIII-1ドメインが逆V字の頂上部を形成している。
リガンドの結合
インスリン受容体 (IR) の内在性リガンドには、インスリン、インスリン様成長因子 (IGF-I、IGF-II) が含まれる。IRの細胞外領域へのリガンドの結合によって受容体内部の構造変化が誘導され、細胞内のβ鎖のTKドメイン内のさまざまなチロシン残基が自己リン酸化される。これらの変化によって、インスリン受容体基質 (IRS)、SH2-B (Src Homology 2-B)、APSといった特定のアダプタータンパク質や、PTP1Bのようなプロテインホスファターゼが呼び寄せられ、血中グルコース濃度の恒常性に関与する下流過程が促進される。
厳密に言えば、IRとリガンドの関係は複雑なアロステリック性を示す。これはスキャッチャードプロットによって示され、IRに結合しているリガンドと結合していないリガンドの比はIRに結合しているリガンド濃度の変化に対して線形関係になく、IRとリガンドは協調的結合を行う関係にあることが示唆されている。さらに、IRとリガンドの解離速度は結合していないリガンドの添加によって加速され、このことは負の協同性があることを意味している。すなわち、IRへの1つ目のリガンドの結合によって2番目の活性部位への結合が阻害される、というアロステリック阻害が起こることが示されている。
IRへのリガンドの結合の正確なメカニズムはまだ構造的に明らかにされていないが、システム生物学によるアプローチによって、現在利用可能なIRの細胞外領域の構造に基づいた、生物学的に妥当な条件下でのIR-リガンド(インスリン/IGF-I)動態についての予測がなされている。
これらのモデルでは、IRの単量体には2つのインスリン結合表面(site 1、2)があるとされる。Site 1はL1ドメインとαCTから構成される「classical」なインスリン結合表面で、site 2はFnIII-1とFnIII-2の接合部に位置し、インスリンの六量体形成面に結合する「novel」な結合表面である。IRの細胞外領域の各単量体は鏡像的相補性を示し、一方の単量体のN末端側のsite 1は、他方の単量体のC末端側のsite 2と向かい合い、反対側も同様となる。現在の文献では、2番目の単量体のsite 1とsite 2をsite 3とsite 4、またはsite 1' とsite 2' と命名することでこの相補的な結合表面を区別している。インスリンが特定の位置(site 1とsite 4/2' またはsite 3/1' とsite 2)に結合すると、リガンドによる結合表面間の「架橋」によって、2つの単量体はより近接する。現在のIR-インスリン動態の数学的モデリングからは、インスリンによる架橋によって2つの重要な帰結がもたらされる。1つ目は、IRへのさらなるリガンドの結合が減少するという、上述したIR-リガンド間の負の協調性である。2つ目は、架橋による物理的な運動によって、細胞内領域がチロシンのリン酸化が起こるコンホメーションとなることである。すなわち、これらの出来事が受容体の活性化と最終的な血中グルコース濃度の恒常性の維持に必要とされるのである。
アゴニスト
- 4548-G05
- インスリン
- IGF-I
- メカセルミン
シグナル伝達経路
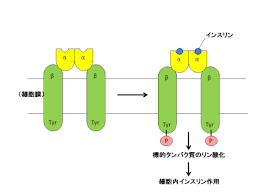
インスリン受容体は受容体型チロシンキナーゼで、アゴニストの結合に伴い各サブユニットが結合パートナーのチロシン残基をリン酸化する。リン酸基の付加によってインスリン受容体基質 (IRS-1) の結合部位が形成され、IRS-1もリン酸化されて活性化される。活性化されたIRS-1はシグナルの伝達を開始し、PI3キナーゼを結合して活性化を行う。PI3キナーゼは、ホスファチジルイノシトール4,5-ビスリン酸 (PIP2) からホスファチジルイノシトール-3,4,5-トリスリン酸 (PIP3) への変換を触媒する。PIP3はセカンドメッセンジャーとして機能し、ホスホイノシチド依存性キナーゼ1 (PDPK1) の活性化を誘導する。このキナーゼは、よく知られたプロテインキナーゼB (PKB/Akt) など、いくつかのキナーゼを活性化する。PKBはグルコーストランスポーターGLUT4を含む小胞を、SNAREタンパク質を介して細胞膜へ輸送させる。これによってグルコースの細胞内への拡散が促進される。またPKBは、グリコーゲンシンターゼを阻害する酵素GSK-3をリン酸化して阻害する。つまりPKBは、グリコーゲン合成過程を開始させ、最終的には血中グルコース濃度を減少させる機能を持つ。
機能
遺伝子発現の調節
活性化されたIRS-1は、インスリンによって調節される遺伝子の転写を促進するための、細胞内のセカンドメッセンジャーとして機能する。まず、Grb2タンパク質のSH2ドメインがIRS-1のリン酸化チロシン残基に結合する。Grb2はSOSに結合できるようになり、SOSはGタンパク質であるRasに結合しているGDPのGTPへの交換を触媒する。これによって活性化されたRasはリン酸化カスケードを開始し、最終的に活性化されたMAPKは核へ移行して核内のさまざまな転写因子 (Elk1など) をリン酸化する。
インスリンの分解
インスリン分子は受容体に結合してその作用を果たした後、細胞外環境へ送り返されるか、細胞内で分解される。通常、分解はインスリン-受容体複合体のエンドサイトーシスを伴い、その後インスリン分解酵素によって分解される。ほとんどのインスリン分子は肝細胞で分解される。典型的なインスリン分子は、血液循環への最初の放出から約71分で最終的な分解が行われる。
免疫系
代謝における機能に加え、インスリン受容体は、マクロファージ、B細胞、T細胞といった免疫細胞でも発現している。T細胞におけるインスリン受容体の発現は休止状態では検出されないが、T細胞受容体の活性化に伴って発現上昇が起こる。事実、インスリンの外的供給によってin vitroでのT細胞の増殖が促進されることが動物モデルで示されている。インスリン受容体によるシグナル伝達は、急性の感染や炎症時にT細胞の潜在的影響力を最大化するために重要である。
病理
インスリン受容体の活性化の主要な役割は、グルコースの取り込みの誘導である。そのため、「インスリン非感受性」もしくはインスリン受容体シグナル伝達の低下によって細胞はグルコースを取り込むことができなくなり、2型糖尿病がもたらされる。その帰結は高血糖と、糖尿病に起因するすべての後遺症である。
インスリン抵抗性の患者は黒色表皮腫を発症することがある。INSR遺伝子のホモ接合変異によって、ドナヒュー症候群 (妖精症) が引き起こされる。この常染色体劣性異常によって、インスリン受容体は完全に機能を持たなくなる。患者には、低位置でしばしば突出した耳、怒り鼻、厚い唇、そして重度の発育遅滞がみられる。ほとんどの場合予後は極めて悪く、出生後1年以内に死に至る。同じ遺伝子の他の変異では、より重症度の低いラブソン-メンデンホール症候群が引き起こされ、患者には特徴的な歯の異常、歯肉の肥大、松果体の増大がみられる。どちらの疾患でも血中グルコース濃度の大幅な変動が見られ、食事後にいったん極めて高値となり、その後異常な低値まで急速に低下する。
相互作用
インスリン受容体はこれらと相互作用することが示されている。
注釈
出典
関連文献
外部リンク
- Insulin receptor - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)